全5回シリーズで「治験と臨床研究」と題したコラムを紹介しています。コラムを担当するのは福岡大学病院臨床研究支援センター長の野田慶太教授です。
野田教授のプロフィルや研究情報はこちらをご覧ください。

1つの新薬を生み出すのには大変な資金と労力が必要です。期間は十数年、開発費用は数百億円掛かるといわれ、2009年の調査によると、2003年から2007年の間に新薬として認可されたのは、21,677候補物質中なんと1つしかありません。今回は、新薬開発の過程を紹介します。
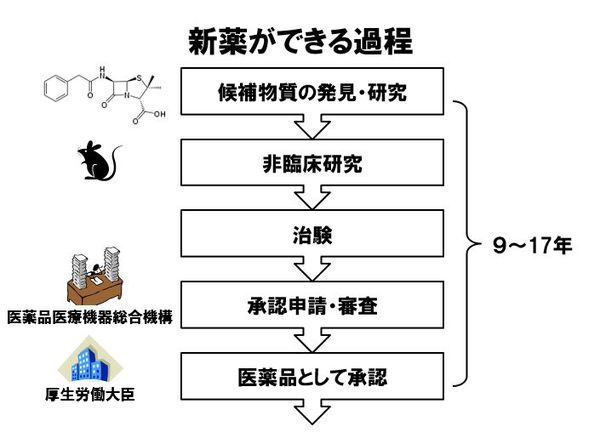
新薬を開発する際は、天然に存在する物質からヒントを得て、それを改良したり、合成したりします。例えば、多くの感染症患者を救った「ペニシリン」は、カビから生まれました。研究者は新薬候補の物質を細胞実験や動物実験で繰り返し検証し、より有効で毒性の少ない物質だけを残します。その後、動物を用いて、毒性や催奇形性(物質を投与された動物から生まれた子供に奇形が見られるかどうか)、がん原性(がんを誘発するかどうか)を調べます。すべてに合格したら、ヒトでの安全性と有効性を調べます。これが「治験」です。
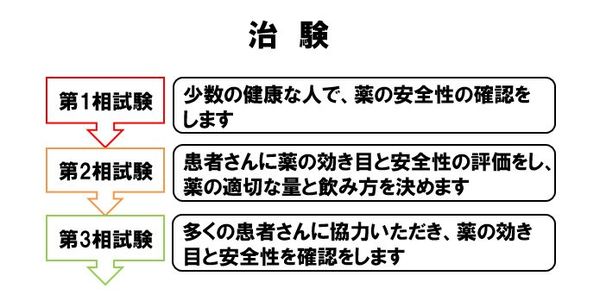
治験とは、新薬候補の物質を国に医薬品として承認してもらうのに必要な臨床試験です。一般的に、治験は3段階(3つの相)で行われます。第I相は「少数の健康な男性(女性は妊娠の可能性があるため避けます)」を対象に、新薬候補の安全性や体の中での代謝(吸収、分解、排泄など)を調べます。第II相は「少数の患者」を対象に有効性や安全性を調べるのと同時に、新薬候補の投与量や投与回数などを比較します。第III相は「多くの患者」を対象に有効性と安全性を調べます。
これまで説明した基礎研究と治験の全データを国(独立行政法人:医薬品医療機器総合機構)が審査し、合格すれば、厚生労働大臣が医薬品として承認します。
![]()
(関連リンク)
